La Farmacocinetica estudia los procesos a los que un fármaco es sometido a través de su paso por el organismo. Trata de dilucidar qué sucede con un fármaco desde el momento en el que es administrado hasta su total eliminación del cuerpo.
Consta de las siguientes fases o pasos:
1.Liberación del producto activo,
2.Absorción del mismo,
3.Distribución por el organismo,
4.Metabolismo o inactivación, al ser reconocido por el organismo como una sustancia extraña al mismo.
5.Excreción del fármaco o los residuos que queden del mismo.
LIBERACIÓN
•Proceso mediante el cual el principio activo presente en una forma farmacéutica queda libre para ser absorbido.
•Para este proceso el fármaco debe estar en solución en los líquidos tisulares o gaseoso en vía pulmonar.
•Las vías intravasculares son las que no contemplan los procesos de liberación y disolución, ya que se obvia la liberación y absorción.
La liberación se realiza en el sitio de la administración (generalmente TGI), comprendiendo 3 procesos:
a)Desintegración
b)Desagregación
c)Disolución.
•Los fármacos en forma de gránulos deben ser sucesivamente desintegrados y degradados para entrar en disolución y así poder ser absorbidos
•Fármacos contenidos en tabletas y cápsulas no sufren desintegración, requieren ser desagregados, para entrar en disolución y así poder ser absorbidos., lo mismo ocurre con las partículas.
•Soluciones farmacológicas (elíxires) se encuentran desintegradas y disueltas al momento de su administración, y solo deben absorberse.
•Supositorios rectales deben disolverse para poder absorberse por la mucosa rectal.
•La disolución es, con frecuencia, el principal factor limitante de la liberación de los medicamentos.
ABSORCIÓN
•Pasaje del fármaco desde el sitio de administración hacia el interior del organismo (usualmente hacia la circulación)
•Zona de absorción: lugar por donde el fármaco penetra a la circulación
•Vía de administración: lugar por donde se suministra el fármaco. No siempre coincide con la zona de absorción. Ej. Fármacos administrados por vía oral se absorben en TGI.
•Por definición cuando un fármaco se administra por vía intravascular el proceso de absorción no existe.
La velocidad de absorción es determinada por:
–La vía de administración
–La dosis
–La rapidez del inicio de acción
Mecanismos de absorción:
•Los medicamentos generalmente se absorben en estado de solución o gaseoso (vía pulmonar). Son los mismos mecanismos que rigen el paso de sustancias a través de las membranas biológicas, y que también explican los mecanismos de distribución y excreción.
•Los medicamentos generalmente se absorben en estado de solución o gaseoso (vía pulmonar). Son los mismos mecanismos que rigen el paso de sustancias a través de las membranas biológicas, y que también explican los mecanismos de distribución y excreción.
Los mecanismos de transporte son:
1.Transporte pasivo o difusión
2.Transporte activo
Transporte pasivo o difusión:
•Siguiendo las leyes físicas de gradientes de concentración, de potencial o de presión hidrostática, en sentido de mayor a menor concentración, sin consumo de energía. Puede ser a través de la membrana propiamente dicha o a través de ciertas proteínas que forman poros. Las formas más comunes son:
•Difusión Simple: puede ser acuosa o lipídica
•Difusión facilitada: con proteínas transportadoras o “carriers”
A.- Difusión simple
Difusión acuosa (filtración).
–Es el paso de una sustancia a través de los poros proteicos presentes en las membranas celulares. Este mecanismo funciona para moléculas insolubles en lípidos (ej. El agua) y para otras sustancias hidrosolubles que sean lo suficientemente pequeñas. Los poros pueden ser atravesados por sustancias con PM menor de 100 a 150 daltons.
–La difusión también puede ocurrir a través de los espacios intercelulares presentes en los capilares (atravesados por sust. Con PM menor a 20000 daltosns).
Difusión lipídica:
–Es el paso de sustancias a través de membranas celulares (lipoproteicas). El fármaco debe disolverse en la bicapa lipídica de la membrana. Es un proceso no saturable, cuya magnitud es directamente proporcional a la liposolubilidad y gradiente de concentración del compuesto. Por este mecanismo difunden el O2, N2, CO2 y muchos fármacos.
–En el caso de ácidos y sales débiles, los cuales pueden asumir formas cargadas (iones) o no, son las formas no ionizadas las que tienen mayor capacidad de atravesar las membranas.
•Ambos procesos de difusión simple (acuosa y lipídica) se caracterizan por seguir la gradiente de concentración y no ser saturables, es decir que si se aumenta la gradiente de concentración, la tasa de difusión simple continúa aumentando proporcionalmente.
•La mayoría de fármacos son ácidos o bases débiles. Por lo tanto, cuando están disueltos en los líquidos tisulares, se encuentran parcialmente disociados (ionizados) y en equilibrio. Los de naturaleza ácida se absorben a pH ácido y los de naturaleza básica a pH alcalino.
B.- Difusión facilitada
•Requiere la acción de proteínas transportadoras específicas o “carriers” en la membrana. Este mecanismo de transporte se utiliza para ciertas sustancias que no poseen la suficiente liposolubilidad y/o no son de un PM lo suficientemente pequeño para atravesar la membrana con facilidad pero que, no obstante deben ser transportadas (Ej. Transporte de glucosa al intracelular o de aminoácidos a través de la barrera hematoencefálica.
•Este tipo de transporte también depende de la gradiente de concentración, pero debido a que el número de moléculas transportadoras es limitado, se caracteriza por ser saturable, es decir, que la velocidad de transporte alcanza un máximo, que no se incrementará aunque se aumente la gradiente de concentración de la sustancia. Además puede haber competencia de diferentes sustancias para utilizar el mismo transportador.
Transporte especializado o activo
•Con gasto de energía.
–Transporte activo propiamente dicho
–Pinocitosis o vesiculación.
•A) Transporte activo (propiamente dicho)
–Se realiza en contra de las gradientes de concentración y requiere de una macromolécula de membrana “carrier” que ejecute el reconocimiento y posterior transporte. Al igual que la difusión facilitada, en este tipo de transporte puede haber competencia y es saturable.
–El calcio, el fluoruracilo, l-dopa son sustancias cuya absorción depende de transportes específicos.
–Son conocidos como “bombas”. Ej bomba de calcio o bomba de sodio y potasio.
•B.- Pinocitosis. (endocitosis y exocitosis)
–Se produce una evaginación de la membrana celular, que rodea a la sustancia que será transportada, la cual luego queda incluida dentro de una vesícula que puede ingresar a la célula (endocitosis) o ser expulsada de ella (exocitosis). Esta modalidad se emplea para las proteinas y macromoléculas con PM mayor a 1000. Ej. Pasaje de hierro, vit B12.
Resumen:
•1.-Transporte pasivo
– A Difusión simple
•Difusión acuosa o filtración
–A través de poros acuosos en membranas
–Zonas corporales con uniones heméticas solo permiten paso de moléculas pequeñas
<150 br="">
•Difusión lipídica
–Pasaje a través de bicapa lipídica
–Favor de gradiente de concentración
–No saturable
–Alto grado de liposolubilidad
•B Difusión facilitada:
•Proceso mediado por transportadores
•Selectivo
•Puede ser competitivo
•Reversible
•Bidireccional
•Saturable
•No requiere energía
•A favor de gradiente de concentración
•Responsable de transporte de azucares, aminoácidos, purinas y pirimidinas.
•2.- Transporte activo
•En contra de la gradiente de concentración
•Requiere energía
•Requiere transportadores específicos Selectividad del sustrato
•Saturable
•Competitivo
•Proceso rápido pero limitado por transportadores
•Movimiento de fármacos a través de túbulos renales, plexo coroideo, hepatocito.
•Generalmente los fármacos no emplean canales celulares para atravesar la membrana, y en pocos casos utilizan un transportador. Lo más frecuente es que se disuelvan en la bicapa lipídica (difusión lipídica), atravesando más fácil a las membranas mientras mayor sea su liposolubilidad.
Factores que modifican la absorción
1.Características del fármaco
2.Características de la superficie absorbente
3.Factores fisiológicos del paciente.
1.- Características del fármaco
–Forma de presentación
•Solubilidad
•Cinética de disolución
–Tamaño de la molécula
–Gradiente de concentración
–Coeficiente de partición líquido/agua (liposolubilidad)
–Grado de ionización
–Influencia del pH
–Atrapamiento o secuestro iónico
2.- Características de la superficie absorbente:
–Área de absorción
–Irrigación
–Vía de administración
–Tiempo de contacto
3.- Factores fisiológicos
–Edad
–Alimentos
–Medicamentos (interacciones)
–Factores fisiológicos o patológicos.
•Grado de ionización
–La mayoría de los fármacos son ácidos o bases débiles, y en solución están parcialmente ionizados.
–Los ácidos débiles donan un protón para formar aniones (-)
–Las bases débiles aceptan un protón para formar cationes (+).
–La ionización que sufren los ácidos y bases débiles es reversible, a diferencia de los ácidos y bases fuertes cuya ionización es unidireccional.
•En las soluciones existen:
•Fracción ionizada: es hidrosoluble y muy poco difusible
•Fracción no ionizada: es liposoluble y difunde con mayor facilidad a través de las membranas lipoproteicas.
•Ácido o base debil implica que la sustancia no se disocia totalmente en sus iones, sino que existe un equilibrio entre la forma ionizada y no ionizada (liposoluble).
•La forma no ionizada difundirá libremente a través de la bicapa lipídica en función de su liposolubilidad; pero la forma ionizada estará dificultada para cruzar la membrana celular debido a la presencia de carga eléctrica que interactúa con los dipolos de agua.
•El grado de ionización de los electrolitos débiles depende de:
–Su constante de disociación (pKa)
–Del pH del medio en que se encuentre.
–El pK de un fármaco representa el pH al cual el 50% de las moléculas en solución están ionizadas:
– pKa=pH+ log[ forma protonada/forma no protonada]
El grado de ionización depende de la naturaleza ácida o básica del compuesto, de su pKay del pH.
•Atrapamiento o secuestro iónico
•Cuando un fármaco se encuentra en dos o más medios biológicos separados por membranas, atrapándose la porción del fármaco no difusible (parte iónica), acumulándose en el medio en el que se concentra la mayor cantidad de su forma iónica. En conclusión el fármaco se concentrará más en el medio en el que predomine su forma ionizada.
•Gracias al secuestro iónico se produce una efectiva acumulación de ácidos en el plasma, mientras que las bases tienden a permanecer en el medio gástrico, debido a las condiciones en las cuales cada sustancia respectiva predomina su forma ionizada de poca movilidad.
CLASIFICACIÓN DE LAS VÍAS DE ABSORCIÓN
1.Vías mediatas (indirectas)
1.Vías mediatas (indirectas)
2.Vías inmediatas (directas o parenterales).
•Vías mediatas: cuando el fármaco ingresa al organismo sin que ocurra efracción del epitelio (piel y mucosas), pueden ser:
–Vía enteral: la administración se hace directamente en el TGI o en una parte de este sistema: (vía oral, sublingual, rectal, gastroclisis, rectoclisis)
–Vía tópica: A través de la superficie de la piel o mucosas: (cutánea, conjuntival, nasal, ótica, pulmonar o inhalatoria, genitourinaria)
•Vías inmediatas
–El fármaco penetra al organismo con efracción del epitelio (inyectables): tenemos:
–Subcutánea (SC); intradérmica (ID);intramuscular (IM); endovenosa (EV); intraarterial; intracardíaca; intralinfática, intratecal o intrarraquídea; intraósea; intraarticular; intrapleural.
VÍAS ENTERALES
•1.- Vía oral:
•1.- Vía oral:
•A través de la boca, con deglución, siendo absorbidos en cualquier segmento del TGI.
•La forma no ionizada del compuesto será absorbida más rápidamente, pero la velocidad de absorción en el intestino es mayor que en el estómago incluso si el medicamento se encuentra en forma predominantemente ionizada en el intestino y ampliamente no ionizado en el estómago.
•Se puede aprovechar la parte no absorbible, como los antibióticos tópicos que actúan en el lumen intestinal o ciertos digestivos.
•Absorción gástrica
–La mucosa gástrica posee epitelio monoestratificado no cornificado, con gran riego sanguineo y una extensa superficie de absorción, pero el tiempo que permanece un fármaco en el estómago depende de la velocidad de vaciamiento gástrico, dependiendo de varios factores.
–El jugo gástrico tiene un pH muy ácido, por lo cual solo los ácidos débiles que no están disociados (ácido salicílico) pueden absorberse , así como algunas sustancias liposolubles como el etanil.
–Una vez absorbidos los fármacos pasan a los capilares sanguienos y vena porta , pasando por el hígado, que puede modificarlos químicamente y aún inactivarlos (efecto del primer paso)
•Absorción en el intestino delgado
–Posee gran área de absorción, aprox. 200 m2, por lo cual constituye la vía de absorción más importante.
–La mucosa intestinal es permeable para las formas no ionizadas liposolubles. Se absorben ácidos débiles con pKa mayor a 2 y bases débiles con pKa menor a 9.
–En el intestino se absorben bases débiles en forma no ionizada, porque el pH es más alcalino que el del estómago (5,5 en la superficie de las vellosidades y 6-7 en la luz intestinal). La absorción es más rápida, debido a la mayor superficie por la presencia de las vellosidades intestinales y a la más rica vascularización de la mucosa.
•Ventajas:
–Fácil y cómoda, segura y económica
•Desventajas:
–Uso limitado a pacientes que puedan deglutir y retener el fármaco, no útil en pacientes inconscientes y que no pueden deglutir
–Inicio de acción lento
–Relativa incapacidad para medir con precisión el grado de absorción
–Fenómeno de primer paso: hígado por la vena porta donde son inactivados total o parcialmente Inactivación gástrica por la acidez
–Irritación gástrica: algunos medicamentos pueden provocar nauseas y vómitos
–Sabor
2.-VIA BUCAL Y SUBLINGUAL
•Útil para la administración de ciertos fármacos como el nifedipino, nitroglicerina, isosorbide, captopril, clonazepam, etc. Se usan tabletas de rápida disolución que se colocan bajo la lengua o en la fosa maxilar entre el carrillo y la encía superior. La absorción se realiza a través de la mucosa bucal.
•Características
–Pequeña superficie de absorción
–Mucosa oral con epitelio poliestratificado no cornificado, con gran capacidad de absorción, se absorbe por difusión simple
–Sustancias muy liposolubles se absorben por difusión simple: estrógenos, andrógenos, nicotina, cocaina.
–Se elude el fenómeno del primer paso, el fármaco llega directamente a la vena cava por las venas lingual y maxilar interna.
–La absorción de fármacos liposolubles es muy rápida y el efecto se observa en menos de 2 minutos ( ej. nitritos)
•Ventajas:
–Facilidad de administración
–Absorción directa por al mucosa oral sin pasaje por el tubo digestivo ni hígado
–Absorción rápida y completa
–Posibilidad de remover el exceso del fármaco si el efecto es muy intenso
•Desventajas:
–Útil solo para algunos medicamentos
–Posible irritación de la mucosa bucal
–Puede ocurrir salivación excesiva que promueva la deglución del fármaco, con pérdida de la ventaja de esta vía
–Mayor incomodidad por esta vía por el sabor de los medicamentos
3.- VIA RECTAL
•Se administra el fármaco en el recto a través del ano. Se emplea con los siguientes fines:
–Actuar localmente sobre las mucosas del intestino grueso
–Provocar por vía refleja la evacuación del colon
–Producir efectos sistémicos en caso que el fármaco se absorba
–En caso de vómitos y pacientes que no cooperan
–Cuando se desea evitar el uso de la vía parenteral
•Características:
–La absorción del colon se hace por transporte activo y pasivo. Se absorben todos los fármacos excepto las proteínas y grasas (la absorción no es facilitada porque no hay jugo intestinal ni pancreático)
–La velocidad de absorción en el colon es menor que en el intestino delgado, porque hay menor superficie absorbente, pero por vía rectal la absorción comienza inmediatamente, en tanto que en el intestino delgado ocurre luego del vaciamiento gástrico, por lo que el inicio de acción es más rápido por vía rectal, pero la absorción no es regular
–Fenómeno del primer paso: Por vía rectal se elude parcialmente el paso por el hígado, porque el 50% de la dosis ingresa por las venas hemorroidales media e inferior, luego a la vena cava y circulación sistémica; el otro 50% va por el plexo hemorroidal superior a la vena porta, luego al hígado
–En esta parte los fármacos no son destruidos por las enzimas digestivas.
•Ventajas:
–Útil cuando no es posible la vía oral
–La absorción más rápido que por vía oral
–Pueden darse fármacos que se inactivan en el estómago y/o intestino delgado
–Se evita parcialmente el fenómeno del primer paso
–Se evita la acción del fármaco sobre el estómago (lesión gástrica)
–No es dolorosa ni traumática
–Permite la auto administración del fármaco.
•Desventajas:
–La absorción no es tan regular ni tan perfecta como otras vías
–Es una vía incómoda para muchas personas
–La presencia de heces en la ampolla rectal dificulta la absorción
–Probabilidad de irritación rectal por administración repetida
–Las fisuras anales y las hemorroides dificultan y aún impiden su uso
–No es útil en caso de diarreas
VÍAS DIRECTAS INMEDIATAS O PARENTERALES
•Para= fuera de Enterón = intestino
•Consiste en hacer llegar un medicamento al organismo a través de una aguja hueca, sin emplear el TGI.
•Requiere de rigurosa asepsia , es dolorosa y el paciente, normalmente, no puede administrarse el medicamento, es mucho más rápido de la VO, más útil en situaciones de emergencia o intolerancia digestiva; pero si hay sobredosificación, es muy difícil retirar el fármaco administrado.
•Existe el peligro de transmisión de infecciones y otros tipos de lesión por mala técnica (100 millones de bacterias por cm2 de piel)
1.- Vía subcutánea
•El fármaco se inyecta debajo de la piel, difunde a través del tejido conectivo y penetra al torrente circulatorio a través de los capilares. Es la vía de elección para administrar a drenalina (anafilaxia) e insulina (DM)
•Características
•Las soluciones deben ser neutras e isotónicas, para evitar irritación, dolor y necrosis
•El masaje, ejercicio y la aplicación de calor en el punto de inyección pueden acelerar la absorción
•La administración de vasoconstrictores o la aplicación local de frío retarda la absorción
•La absorción es lenta e inconstante.
•Se explota la existencia de una rica red capilar en el tejido subcutáneo; suele ser más rápida que la intramuscular. El medicamento se inyecta en el tejido conjuntivo laxo situado debajo de la piel. La cantidad usualmente oscila entre 0,5 y 2 mililitros.
•Ventajas
–Permite la administración eficaz de ciertos fármacos y de algunas hormonas.
–La absorción en general es rápida y eficiente debido al acceso directo a los vasos sanguíneos del tejido subcutáneo.
•Desventajas
–Puede causar reacciones adversas.
–No es aplicable con sustancias irritantes.
2.- Intravenosa:
•Vía parenteral por excelencia, dado que existe suficiente cantidad de venas superficiales de buen calibre que son muy accesibles (debido a que hay una red venosa superficial y una profunda, lo que no ocurre con las arterias). Implica la previa disolución del fármaco en un líquido (generalmente agua) o vehículo, junto con el cual se administra directamente en la circulación, por lo que no se produce el proceso de absorción.
•Hay dos formas básicas de administración, que son la inyectable y la perfusión continua (a través de equipos especiales). El tipo, cantidad y velocidad de la perfusión están determinados por los requerimientos fisiológicos del paciente.
•Ventajas
•a) Permite la obtención de la concentración deseada del medicamento con exactitud.
•b) Es factible aplicar sustancias irritantes.
•c) Permite infundir grandes volumenes de líquido, lo que sería imposible mediante otras vías de administración.
•d) Ofrece control sobre la entrada del fármaco.
•e) La totalidad del fármaco administrado llega a la circulación sistémica sin pasar por un proceso de absorción.
•Desventajas
•a) Una vez introducido el compuesto farmacológico no se puede retirar de la circulación.
•b) Surgen reacciones adversas con mayor intensidad.
•c) Es imposible revertir la acción farmacológica.
•d) Ofrece dificultades técnicas mayores que las otras vías parenterales, sobre todo si hay carencia de venas accesibles.
3.- Intramuscular:
•Aprovechando la amplia vascularización del tejido muscular, puede administrarse en el mismo una droga, la cual pasará a la circulación por los capilares. Esta administración suele retardar un poco la absorción, por lo que se considera la posibilidad de formación de depósitos de las drogas administradas, las cuales se van liberando lentamente a la sangre. No suelen administrarse más de 3 mililitros de volumen por esta vía (de hecho, ya la administración de tal cantidad genera un dolor bastante notable). Vol. Max 10 ml.
•Ventajas
•Permite la inyección de sustancias levemente irritantes.
•Permite la inyección de líquidos oleosos con acciones más lentas y sostenidas.
•La absorción es segura.
•Desventajas
•La inyección de sustancia oleosa es capaz de provocar embolismo pulmonar con desarrollo ulterior de infarto en ese órgano.
•Producción de escaras y abscesos locales.
•La inyección en el nervio ciático por error puede producir parálisis y atrofia de los músculos en el miembro inferior.
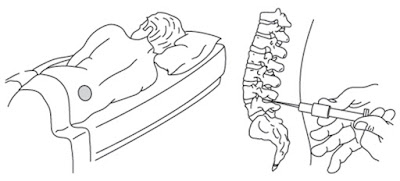
4.- Epidural - Intratecal:
•Vías especiales, de uso más localizado, cuando se quiere evitar el paso por la barrera hematoencefálica para causar un efecto en el SNC (se accede directamente al líquido cefalorraquídeo). Puede usarse para la administración de antimicrobianos, pero lo más común es la administración de anestésicos locales.
•Ventajas
–Las ventajas de esta vía consisten en la posibilidad de actuar de forma eficiente sobre las meninges y raíces raquídeas.
•Desventajas
–Sus desventajas consisten en la dificultad técnica y la posibilidad de que ocurran efectos adversos como sobreinfecciones, hemorragias y parálisis.
5.- Intradérmica:
•El medicamento se inyecta en la dermis, inmediatamente debajo de la epidermis. El volumen a administrar tiene que ser sumamente pequeño (hasta 0,1 ml) y la absorción definitiva suele resultar bastante lenta. Tras la inyección debe aparecer una pequeña ampolla o roncha en el sitio de aplicación.
•Ventajas
–Sus ventajas consisten en que lleva la sustancia al punto de acción.
•Desventajas
–Se refiere a una cierta dificultad en la técnica.
6.- Otras Vías Intravasculares:
•Similar a la vía intravenosa desde el punto de vista de la biodisponibilidad.
•Las arterias poseen una menor accesibilidad a la punción y una mayor presión dentro de las mismas, que confiere una mayor importancia relativa a la lesión que se origina (y una ligeramente mayor resistencia a la inyección). La administración intracardíaca es una forma especial de la intraarterial, usada muy raramente, mientras que la administración intralinfática es solamente teórica.
Vía intraosea
•Es la administración de soluciones en la médula ósea por punción del esternón en el adulto o de la tibia en el niño pequeño. Se utiliza cuando está indicada la vía intravenosa, pero no existen venas disponibles
•Ventajas
–Las ventajas consisten en su rapidez de acción.
•Desventajas
–Las desventajas son las dificultades técnicas, de manera que en la actualidad se emplea muy poco.
Vía intraperitoneal
•Es la introducción de soluciones en la cavidad peritoneal; se realiza para efectuar el método de diálisis peritoneal
•Este procedimiento se emplea en los casos de insuficiencia renal, eliminación de urea y de potasio en exceso, y en las intoxicaciones por barbitúricos y salicilatos, principalmente.
•Ventajas
–Sus ventajas consisten justo en su sencillez y en estar al alcance del médico, sin que exista necesidad de contar con un equipo costoso o muy especializado como es el caso del riñón artificial.
•Desventajas
–Sus desventajas consisten en la posibilidad de hemorragia, peritonitis, infección y formación de adherencias.
OTRAS VIAS
•Tópica: El sitio de administración de las drogas es el mismo sitio en el que se pretende lograr su efecto terapéutico. Ej. preparados oftálmicos, dermatológicos y del árbol bronquial, etc.
•Respiratoria o inhalatoria: En este caso, se administran las drogas a través del árbol respiratorio, bien sea para obtener un efecto localizado (uso de broncodilatadores para el asma) o para que el fármaco difunda la barrera alveolo - capilar y pase a la circulación (anestésicos generales: Gases o líquidos volátiles).
•Percutánea: Ciertos fármacos pueden atravesar la piel, pero aún en condiciones muy favorables, lo hacen muy lentamente; de esta manera, al administrar fármacos sobre la piel se puede mantener un flujo más o menos continuo de la droga al organismo, si bien la magnitud de dicho flujo puede ser muy variable (como por ejemplo, los parches de nicotina para calmar los síntomas de abstinencia del tabaco o buprenorfina para manejo del dolor)
•Iontoforética:
•Se utiliza corriente eléctrica directa o alterna para poder conducir moléculas cargadas a través de las membranas biológicas, especialmente para alcanzar tejidos más profundos a través de la piel. Una droga se coloca bajo un electrodo que tenga el mismo tipo de carga que ella, colocando en otro lugar un electrodo con una carga opuesta.
•El fármaco, ha de ser hidrosoluble, ionizable con una alta densidad de carga y administrable en dosis bajas y de bajo peso, aplicable también a ciertas drogas de tamaño importante.
•Se han realizado diversas pruebas con fármacos como la insulina, la vidarabina, la hialuronidasa, algunos corticoides, ciertos antimicrobianos y la lidocaína. Para el examen de ciertas sustancias presentes en la piel, se puede revertir la corriente eléctrica habitual para lograr lo que se conoce como “iontoforesis reversa”, misma que ha sido comprobada por ejemplo para medir los niveles de glucosa subdérmica en pacientes con diabetes.
•Fonoforética: (sonoforética)
•Consiste en el uso del ultrasonido, bien sea de manera continua o por pulsos, para lograr que ciertos medicamentos, especialmente anti inflamatorios o analgésicos, puedan llegar a atravesar la piel intacta, llegando entonces al tejido subcutáneo (administración transdérmica). Este método se basa aparentemente en la desagregación de los estratos superficiales de la piel, lo que permite que se produzca el paso de sustancias a través de los mismos.
DISTRIBUCIÓN
•Llegada y disposición de un fármaco en los diferentes tejidos del organismo. Es un proceso muy importante, toda vez que, según su naturaleza, cada tejido puede “recibir” cantidades diferentes del fármaco, el cual, además, pasará allí tiempos variables.
COMPARTIMIENTOS DEL ORGANISMO:
•Cada uno de los órganos y tejidos del organismo presentan diferencias de flujo sanguíneo, considerado como un compartimento,: (modelo policompartamental), de estudio muy complejo.
•Cada compartimiento se entiende como un espacio orgánico dentro del cual la concentración del fármaco es homogénea o uniforme.
Modelos Farmacocinéticos
•1.- modelo monocompartimental: presupone que las concentraciones plasmáticas del fármaco son fiel reflejo de las concentraciones en otros fluidos o tejidos, y que la eliminación del fármaco es directamente proporcional a los niveles en el organismo del fármaco (cinética de primer grado)
•En contra de este modelo: No todos los tejidos presentan la misma riqueza en aporte sanguíneo, por lo que en unos la distribución del fármaco será más lenta que en otros. Además, existen algunos tejidos (como por ejemplo el tejido del cerebro) que presentan una verdadera barrera a la llegada de los fármacos.
•Se le conoce como farmacocinética lineal porque al graficar la relación los distintos factores implicados (dosis, concentraciones en el plasma sanguineo, eliminación, etcétera) la representación gráfica es una recta o una aproximación a ella. Es muy útil para fármacos que se distribuyen con rapidez desde el plasma a otros fluidos y tejidos.
•2.- modelo bicompartimental : considerando en cual compartimento se produce la eliminación. Lo más frecuente es que la misma se produzca en el compartimento central, ya que el hígado y riñones son órganos muy bien irrigados. No obstante, puede darse la situación de que la eliminación se realice desde el compartimento periférico o incluso desde ambos. Obtenemos así al menos tres variedades de modelo bicompartimental, que sin embargo sigue sin explicarnos todas las posibilidades.
•3.- Modelo policompartamental:
•O farmacocinética no lineal, y se basa en la cinética de Michaelis-Menten, presenta los sgtes. Factores:
a)Absorción polifásica: La absorción del fármaco sigue al menos dos picos de máxima intensidad. La naturaleza del fármaco hace clara distinción entre tejidos de alta y baja irrigación.
b)Saturación enzimática: En fármacos en los que su eliminación es dependiente de su biotransformación, al aumentar la dosis, las enzimas responsables de su metabolismo se saturan y la concentración plasmática del fármaco aumenta desproporcionalmente, por lo que su depuración deja de ser constante.
c)Inducción o inhibición enzimática: Algunos fármacos tienen la capacidad de inhibir o estimular su propio metabolismo, en una reacción de retroalimentación. Tal es el caso de fluvoxamina, fluoxetina y fenitoina. Al administrar mayores dosis de estos medicamentos, las concentraciones plasmáticas de fármaco sin metabolizar aumenta y el tiempo medio de eliminación aumenta con el tiempo.
d)El riñón establece mecanismos activos de eliminación para algunos fármacos, independientes de los niveles de concentración plasmática.
•Biodisponibilidad
• Fracción del fármaco que alcanza la circulación sistémica del paciente. O dicho de otra manera, el porcentaje de fármaco que aparece en plasma. . La administración de un fármaco por vía intravenosa, presentaría la mayor biodisponibilidad posible, por lo que se considera la unidad (o el 100%). A partir de aquí, la biodisponibilidad se calcula comparando la vía a estudiar con respecto a la vía intravenosa («biodisponibilidad absoluta») o a un valor estándar de otras presentaciones del fármaco en estudio («biodisponibilidad relativa»).
•Cuando dos fármacos tienen la misma biodisponibilidad se dice que son equivalentes biológicos o bioequivalentes. Este concepto de bioequivalencia es importante porque en la actualidad es la vara de medir para la autorización de los medicamentos genéricos en numerosos países.
•Según dos tipos de flujo sanguíneo: “alto” y “bajo”, se reconocen dos compartimientos principales (modelo bicompartamental):
•Compartimiento Central:
–Constituido por tejidos altamente irrigados, que, deben recibir de manera muy rápida el aporte de una droga que pueda estar presente en la sangre. Ej: El plasma, los pulmones, el corazón, las glándulas endocrinas, el hígado, el Sistema Nervioso Central en general y el riñón.
•Compartimiento Periférico:
–Constituido por tejidos menos irrigados, reciben tardíamente el fármaco desde la circulación sistémica, y pueden a acumularlo, dependiendo de su “afinidad” por el mismo. Entre estos tejidos se encuentran la piel, el tejido adiposo, el tejido muscular, la médula ósea y ciertos depósitos tisulares.
MODELOS DE DISTRIBUCIÓN
•Monocompartamental:
•En el cual se considera homogéneo a todo el organismo; es este un modelo sumamente sencillo, por lo cual no concuerda con muchos de los aspectos de la farmacocinética habitual de las drogas. Excepción el plasma.
•El Volumen Aparente de Distribución se puede explicar en el modelo monocompartamental. y permite establecer ciertas inferencias acerca de los volúmenes del organismo que son efectivamente ocupados por el fármaco.
•Multicompartamental:
•Cada tejido es considerado un compartimiento diferente, lo cual es un aspecto que se relaciona con las diferencias anatomo - funcionales de cada uno, representa la “verdadera” compartamentalización, llegando a ser, no obstante, demasiado complejo como para permitir un estudio matemático detallado.
•Bicompartamental:
•Existencia de dos Compartimientos, (central y periférico). Los procesos por los cuales cambia la concentración plasmática dependen tanto de la eliminación, como del paso de la droga a tejidos de baja irrigación, lo que conlleva a que estos cambios de concentración sean bifásicos.
Factores que afectan la distribución
1.Volúmenes Físicos del organismo,
2.Tasa de Extracción
3.Unión a Proteínas Plasmáticas y/o Tisulares.
VOLÚMENES FÍSICOS DEL ORGANISMO
•Este aspecto implica el considerar a cada espacio volumétrico del organismo como un “solvente” para los fármacos que representan los respectivos solutos.
•Puede correlacionarse con el modelo multicompartamental, reconociéndose los siguientes “Compartimientos”, con ejemplos de los tipos de fármaco que a cada uno accede:
TASA DE EXTRACCIÓN
•Se refiere a la proporción del fármaco que es retirado de la circulación por cada órgano, una vez que el flujo sanguíneo lo haya hecho pasar a través de dicho órgano. Depende de diversos factores, todos relacionados con la transferencia de drogas:
•1. Depende de las Características Físicas y Químicas del Fármaco:
–Liposolubilidad
–Tamaño molecular
–pKa de drogas ionizables
–Tasa de perfusión tisular, como medida del “acceso” del fármaco a cada tejido – redistribución.
•Redistribución:
•Se refiere a la remoción de la droga del tejido al cual se había distribuido primariamente (más irrigado), para pasar a otros de menor irrigación pero mayor afinidad, el equilibrio final tarda mucho más en alcanzarse; sin embargo, desde el punto de vista clínico, se observan dos períodos diferentes:
–Uno inicial en el que el efecto no se correlaciona con las concentraciones plasmáticas de la droga, pudiendo ser máximo (si el tejido blanco es altamente perfundido) o mínimo (si el tejido blanco es poco perfundido, es decir, que no pertenece al compartimiento central).
–Uno secundario, en el cual la distribución ya se ha realizado completamente, es decir, que se ha logrado el equilibrio. En este período, la respuesta farmacológica tiene generalmente una buena correlación con las concentraciones plasmáticas.
3.Depende del Gradiente de Concentración
4.Depende de la superficie de intercambio
5.Depende de la tasa de permeabilidad de lechos vasculares
6.Depende de la presencia de Barreras: Las “barreras” en el organismo generalmente denotan mecanismos, usualmente vasculares, por medio de los cuales ciertos tejidos permiten solo el paso selectivo de ciertas moléculas. Entre estas barreras se encuentran la hematoencefálica, la placentaria, la hematoocular, la hematotesticular y la barrera plasma - líquido sinovial
•UNIÓN A PROTEÍNAS
•Las proteínas en general (y las plasmáticas en particular: albúmina, glucoproteínas, lipoproteínas) con capacidad de unirse a diferentes fármacos. Esta interacción tiene ciertas características en común con la que se produce entre un ligando y un receptor, en el sentido de que se sigue la Ley de Acción de Masas, tiene una capacidad finita , (puede producirse saturación de la unión) y entraña la posibilidad que se presenten fenómenos de competición. La unión de fármacos a proteínas suele ser de poca especificidad y, por ende, de baja afinidad.
•Esta unión determina un factor importante de la distribución, toda vez que la fracción unida de la droga, por no tener capacidad de ser transferida, no forma parte del equilibrio vascular – tisular (“reservorio”), no se metaboliza, no es excretada y no induce el efecto farmacológico (a menos que el mismo esté determinado por la unión mencionada).
•Ciertos fármacos pueden desplazar a otros de su unión a proteínas plasmáticas, aumentando, por ende, la fracción libre del desplazado, lo que conlleva a mayor efecto farmacológico.
•Aunque la unión a proteínas tisulares también es determinante de la distribución de fármacos, la influencia de la unión a las proteínas plasmáticas (UPP) es mucho más importante, ya que la unión a proteínas tisulares es relativamente reducida. Debido a que la concentración plasmática de proteínas es notablemente mayor que la intersticial de los tejidos (y además, por el medio en el que existen, tienen mayor capacidad de establecer interacciones).
•Se observa que para valores de UPP inferiores al 70 % siempre se obtienen altos niveles de fármaco en los tejidos (más del 80 % del fármaco administrado pasa a los tejidos), acumulándose la mayor parte (> 50 %) del fármaco en el plasma solamente cuando la UPP es superior a 90 %.
•Estos planteamientos también implican que el efecto del desplazamiento de un fármaco por otro no está determinado solamente por la magnitud del desplazamiento, sino que también depende de cuál era la UPP original que presentaba el fármaco que es desplazado. Esta aseveración se ejemplifica en esta figura:
Segùn el porcentaje de uniòn a PP existen diferentes desplazamientos
•En el caso de que el valor de UPP sea muy alto, incluso desplazamientos sumamente limitados podrían ser capaces de aumentar de manera muy notable la concentración tisular del fármaco desplazado, al punto de que un desplazamiento menor al 2 % podría ser capaz ya de duplicar dicha concentración tisular si la UPP original es del 99 %.
•En el caso de fármacos con UPP más baja, la concentración tisular se modifica poco. En el fármaco con UPP de 95 % se requiere de un desplazamiento al 90 % para duplicar la concentración libre del fármaco, lo que contrasta con el caso planteado para una UPP de 99 %.
•Para el tercer fármaco (UPP = 90 %), ni siquiera el desplazamiento total de su unión a proteínas puede llegar a afectar de una manera importante la concentración tisular del mismo.
•Solamente cuando la UPP original de un fármaco desplazado es SUMAMENTE ALTA, puede esperarse que su concentración tisular muestre incrementos significativos (con el consiguiente riesgo aumentado de toxicidad).
•La unión a las proteínas es usualmente lábil y reversible, generalmente a través de enlaces iónicos, puentes o enlaces de hidrógeno, fuerzas de Van der Walls y raramente enlaces covalentes. La fracción ligada a las proteínas guarda siempre un equilibrio con la fracción libre.
•solo esta fracción de moléculas libres puede atravesar las membranas que separan los distintos compartimientos, por lo que de ella dependen los efectos terapéuticos. Cuando moléculas de la fracción libre salen del plasma y se distribuyen en el organismo, una fracción equivalente de moléculas se desliga de las proteínas y pasa a reemplazar a las moléculas de la fracción libre. De esa manera la proporción fracción ligada/fracción libre se mantiene constante aunque la concentración total vaya disminuyendo progresivamente en el plasma.
•La fenilbutazona se fija en un 98% a las proteínas plasmáticas.
•La cloropropamida se fija en un 80% a las proteínas plasmáticas.
•El tiopental se fija en un 65% a las proteínas plasmáticas.
•El barbital se fija en un 5% a las proteínas plasmáticas.
•La antipirina no se fija a las proteínas plasmáticas.
•La vida media plasmática depende parcialmente de la unión del fármaco a las proteínas plasmáticas ya que la fracción ligada no puede atravesar las membranas, no filtra por los glomérulos y no está expuesta a los mecanismos de la biotransformación.
•La capacidad de fijación a las proteínas no es ilimitada: se saturan y luego aparecen los signos de intoxicación.
•La concentración de proteínas en plasma es otro factor importante, en hipoalbuminemias por ej. pueden aparecer manifestaciones de sobredosis con dosis terapéuticas de un ácido débil, situación esta a tener en cuenta en patologías como la nefrosis y hepatopatías grave
DEPÓSITOS DE DROGAS EN EL ORGANISMO
•Algunos fármacos poseen mayor afinidad por algunos componentes tisulares, fijándose a los mismos en mayor concentración, constituyendo prácticamente depósitos de esas drogas en el organismo. Las drogas pueden depositarse en:
•1. Proteínas plasmáticas e hísticas: Por ej. la quinacrina se fija a proteínas del hepatocito alcanzando una concentración miles de veces superior a la del plasma.
•2. Tejido conectivo: Algunas drogas se fijan a los grupos fuertemente iónicos de los mucopolisacaridos del tejido conectivo que actúa así como un depósito del fármaco.
•3. Huesos y dientes: Algunos agentes como los metales pesados y las tetraciclinas se fijan intensamente a los huesos y a los dientes, posiblemente por quelación con el ion calcio.
•4. Tejido lipoideo: Drogas muy liposolubles pueden almacenarse en tejido lipoideo. Los barbitúricos, la fenoxibenzamina, la dibencilina y el DDT se acumulan en tejido.
•5. Otros tejidos: El antimicótico griseofulvina se acumula especialmente en la piel, por lo que es útil en micosis cutáneas aún cuando se administre por vía gastrointestinal. El antihipertensivo guanetidina tiene gran afinidad por el corazón y el músculo estriado, el antiarrítmico amiodarona tiene afinidad por fluidos oculares.
BARRERAS NATURALES
1.- Barrera hematoencefálica:
1.- Barrera hematoencefálica:
•Está localizada entre el plasma sanguíneo de los vasos cerebrales y el espacio extracelular del encéfalo.
•El paso de las drogas en el cerebro aunque está sujeto a las mismas leyes que rigen el pasaje de drogas a través de otras membranas biológicas, presenta claras diferencias, ya que muchas drogas atraviesan con mucha dificultad o directamente no atraviesan esta barrera, alcanzando niveles de concentración muy diferentes a otros órganos o tejidos.
•Desde el punto de vista microscópico-histológico se han demostrado algunas diferencias en la estructura de los capilares cerebrales.
•Así, por ej. las células endoteliales poseen uniones intercelulares muy íntimas, más estrechas que en otros capilares y se observa un mayor número de mitocondrias, indicando presuntamente una mayor actividad enzimática.
•Los capilares cerebrales tampoco demuestran la existencia de vesículas pinocitócicas y se encuentran rodeados en forma muy estrecha por células especiales de la glía llamadas astrocitos.
•Para que un fármaco llegue el espacio intersticial del neuroeje debe atravesar estas estructuras diferentes de otros endotelios, lo que determina la existencia de dicha barrera.
•Se denomina ruptura de la barrera hematoencefálica al incremento de la permeabilidad de la misma; puede producirse por: hipercapnia, convulsiones repetidas, infecciones virales o bacterianas, HTA, meningosis leucémica, meningitis, irradiación con rayos X. Esta ruptura es importante para explicar la patogenia del edema cerebral.
•2.Barrera sangre líquido cefalorraquídeo
•Esta localizada a nivel de los plexos coroideos e impide el paso de ciertas drogas al LCR. Los capilares de los plexos coroideos son similares a los capilares extracraneales, pero se encuentran recubiertos por células epiteliales que posiblemente sean responsables de las diferencias en la absorción. En general los antibióticos solo alcanzan un porcentaje de la concentración plasmática cuando se administran por otra vía que no sea la intratecal. En tal sentido la inflamación de las meninges puede modificar el pasaje de drogas a través de la misma.
•3.Barrera placentaria
•Es especialmente importante la administración de cualquier droga en el período de la organogénesis que comprende en forma práctica el primer trimestre del embarazo, ya que los fármacos liposolubles, no ionizados pasan con facilidad y por difusión pasiva la barrera placentaria, por ej. la morfina, anestésicos gaseosos, líquidos volátiles, salicilatos sulfamidas, benzodiacepinas, neurolépticos, el alcohol, etc. La glucosa y otras hexosas atraviesan la placenta por difusión facilitada, los iones y aminoácidos por transporte activo, las inmunoglobulinas y proteínas por pinocitosis. Los amonios cuaternarios no atraviesan la placenta.
•4.Barrera hematoocular
•En el ojo el epitelio de los procesos ciliares es una barrera difícil de atravesar, por ello la mayoría de los fármacos, no alcanzan niveles terapéuticos en humor acuoso ó vítreo, cuando se administran por via parenteral.
•Redistribución de los fármacos:
•Algunos fármacos sobre todo aquellos muy liposolubles y que atraviesan con facilidad las membranas por difusión pasiva, sufren el proceso de redistribución. Por ej. el tiopental sódico, barbitúrico de acción ultracorta, que después de su administración i.v. alcanza rápidamente elevadas concentraciones en tejidos cerebrales, por su gran afinidad a los fosfolípidos del cerebro, su difusibilidad y por el gran flujo sanguíneo cerebral.
•El efecto farmacológico desaparece luego de algunos minutos, mientras el tiopental se redistribuye en los tejidos mencionados(músculo estriado, hígado, riñón y tejido adiposo). Es decir que se ha desarrollado una distribución primaria selectiva y posteriormente una redistribución.
METABOLISMO DE LOS FÁRMACOS
•Es la transformación química de sustancias (habitualmente mediada por enzimas) que ocurre en el organismo, razón por la que a veces se le conoce como biotransformación.
•Es la transformación química de sustancias (habitualmente mediada por enzimas) que ocurre en el organismo, razón por la que a veces se le conoce como biotransformación.
•La vía renal es la vía fundamental de eliminación, pudiendo darse la misma con mayor facilidad cuando se busca “expulsar” las sustancias altamente polares; por el contrario, los fármacos liposolubles resultan de más laboriosa excreción, por lo que corrientemente deben ser transformados en compuestos más solubles, más polares, los cuales, en consecuencia, también han de resultar más fáciles de ser excluidos del sistema biológico implicado.
•Los productos de la biotransformación, conocidos como metabolitos, generalmente, presentan una menor actividad farmacológica que las drogas originales; sin embargo, hay casos en los que dicha actividad se puede ver mantenida, incrementada o alterada, incluyendo aquellas circunstancias en las que el metabolito resulte incluso más tóxico que el precursor.
•Activación del fármaco.
•Cuando un fármaco administrado no presenta actividad (“profármaco” o “prodroga”), adquiriéndola solo si es biotransformado, en un proceso conocido como bioactivación. En este caso la respuesta no depende de la concentración del fármaco, sino de la concentración de su metabolito.
•Usualmente, la administración de la prodroga y no del fármaco activo se basa en razones farmacocinéticas de liposolubilidad: La prodroga sería más liposoluble, por lo que sería absorbida en gran extensión y generaría concentraciones plasmáticas de la forma activa que serían mayores a las obtenidas con la administración directa de dicha forma.
•Ej. El enalaprilato (fármaco activo), cuya absorción por el tracto gastrointestinal es menor del 10 %; en cambio el enalapril, que es el profármaco correspondiente, tiene una absorción igual a 60%, siendo convertido fácilmente a su forma activa por medio de hidrólisis hepática.
•La biotransformación es el principal proceso que determina la eliminación de fármacos.
SISTEMA OXIDATIVO MICROSOMAL HEPÁTICO
•Función: oxidación de los fármacos para aumentar su hidrosolubilidad y favorecer su excreción.
• Es el sistema más utilizado en el metabolismo de los fármacos.
• Enzimas: oxigenasas que forman el llamado citocromo P450 (CYP450) y se encuentran adosadas al retículo endoplasmático de las células hepáticas.
•Se han identificado más de un centenar de isoenzimas diferentes de cit P450: gran variabilidad interindividual en el metabolismo de fármacos.
•Citocromo p450
•Es una familia de hemoproteinas constituidas por una parte proteica (apoproteina) y un grupo heme prostetico (que contiene hierro) y que difieren ligeramente entre si por su PM, espectro de unión al CO, propiedades electroforéticas, inmunológicas y su actividad catalítica frente aa diferentes sustratos.
•El nombre deriva de su máximo de absorvancia espectral, que se encuentra próximo a los 450 nm cuando el CO se une a la enzima en su estado reducido.
•Se conocen por lo menos 13 familias de CYP, con 22 subfamilias (A,B,C,D, etc).
•La CYP 3A4 es la isoforma más común, representa el 30 – 60% de las isoenzimas a nivel hepático y el 70% de las formas intestinales, interviene en casi la biotransformación de casi todos los fármacos y se expresa a niveles notables fuera del hígado. Es responsable de la eliminación presistémica intestinal.
FASES DEL METABOLISMO
•Reacciones de Fase I:
•Anteriormente conocida como “fase de oxidación”, por el fenómeno redox, siendo los fármacos catalizados por enzimas oxidasas de función mixta generalmente; sin embargo, existen otras posibles transformaciones, como la hidrólisis y la reducción, que pueden presentarse en este momento, pudiendo comprenderse mejor esta etapa como una fase de cambio de grupos funcionales (eliminándolos o exponiéndolos), con alteraciones menores del peso molecular de la sustancia original. En general, se da lugar en esta fase a metabolitos más polares, que pueden o no tener menor actividad que el precursor. Entre las reacciones de fase I más frecuentes se encuentran: Dealquilación, Hidroxilación, N - Oxidación, S - Oxidación, Deaminación, Hidrólisis y Reducción.
•Reacciones de Fase II:
O de conjugación, se produce la unión covalente de un fármaco (o un metabolito generado de fase I) con sustancias más polares, siendo la más común la unión con ácido glucurónico. Los metabolitos obtenidos son altamente polares y rara vez presentan actividad farmacológica.
O de conjugación, se produce la unión covalente de un fármaco (o un metabolito generado de fase I) con sustancias más polares, siendo la más común la unión con ácido glucurónico. Los metabolitos obtenidos son altamente polares y rara vez presentan actividad farmacológica.
•Estas acciones pueden o no ocurrir para un fármaco dado, pero cuando se presentan ambas el metabolito obtenido es sumamente soluble en comparación con la molécula original y se excreta generalmente por vía urinaria. Aparte de la glucuronidación, hay otras sustancias que pueden conjugarse con drogas o con sus metabolitos, como lo son el sulfato, la glicina y el acetato.
•En el contexto de la protección del organismo contra xenobióticos, hay ciertos fenómenos de transporte que actúan en concierto con las fases metabólicas que se han descrito. Así, en células como los enterocitos existen bombas de eflujo que reducen la carga intracelular de tóxicos (o sus metabolitos) y/o reducen la entrada de sustancias tóxicas y este tipo de proceso se ha llamado a veces “metabolismo de fase III”, aunque no entraña cambios químicos de las drogas. En el mismo contexto, la eliminación directa de los xenobióticos ha sido denominada “metabolismo de fase 0”.
•LUGARES DEL METABOLISMO DE FÁRMACOS
•El hígado es el principal órgano para la biotransformación de los fármacos, pero también puede darse el metabolismo en otros niveles (plasma, estómago, intestino, pulmón, cerebro, etc.). Dado que los fármacos administrados por vía oral deben pasar primero por la circulación portal no es imposible que los mismos sufran cierto grado de metabolismo antes de pasar a la circulación sistémica, en lo que se conoce como “Efecto de Primer Paso Hepático”; este fenómeno conlleva a una disminución de la biodisponibilidad de los fármacos y forma parte de un conjunto de procesos que se denominan en su conjunto como procesos de eliminación presistémica (el metabolismo intestinal también contribuye a este proceso).
FACTORES QUE AFECTAN EL METABOLISMO DE LOS FÁRMACOS
•Edad: Los recién nacidos tienen sistemas enzimáticos inmaduros y los ancianos tienen sistemas enzimáticos en degeneración, lo que favorece la aparición de toxicidad con aquellos fármacos cuya eliminación sea básicamente hepática (o pérdida de efecto si el metabolismo hepático lleva a bioactivación).
•Diferencias genéticas: Por la variedad genética, misma que incluye la presentación de distintos patrones enzimáticos en individuos por demás normales. Los siguientes son solo algunos ejemplos de esta variabilidad:
•Acetilación: La existencia de dos sub - poblaciones, de “acetiladores rápidos” y de “acetiladores lentos”, dependiendo esta última de una baja actividad de N - acetiltransferasa hepática. Los acetiladores lentos son más sensibles a las manifestaciones tóxicas de algunas drogas, como por ejemplo la neuritis periférica con la isoniacida, un fármaco utilizado para el tratamiento de la tuberculosis (en los acetiladores rápidos la respuesta terapéutica a la isoniacida pudiera ser menor que en los lentos).
•Hidrólisis: Un ejemplo de esta variación es la deficiencia de pseudo - colinesterasa plasmática, que causa un efecto más prolongado de drogas como la succinilcolina (bloqueo neuromuscular extremo con la posibilidad de parálisis respiratoria importante).
•Déficit enzimático:
–Glucosa - 6 - fosfato deshidrogenasa: Esta enzima mantiene la integridad del citoesqueleto y su actividad es baja en 10 % de la población negra, por lo que puede haber anemia hemolítica con el uso de ciertas drogas con actividad oxidativa (cloroquina, aspirina, vitamina K, etc.).
–Glutatión Sintetasa: La deficiencia de esta enzima es más rara que la de Glucosa - 6 - fosfato deshidrogenasa, pero también sensibiliza a los pacientes ante el efecto de drogas oxidantes, por lo que la toxicidad de agentes como el acetaminofén puede aumentar.
•Sexo: Ej. en ciertas condiciones fisiológicas, como el embarazo o ciertas fases del ciclo menstrual.
•Enfermedades: Las enfermedades hepáticas pueden afectar de manera importante el metabolismo de los fármacos, aumentando la toxicidad de los mismos o produciendo ineficacia terapéutica si el fármaco administrado requiere del metabolismo hepático para su bioactivación.
•Dieta: Puede haber alimentos que puedan ocasionar cambios en el metabolismo, aunque frecuentemente los mismos no suelen ser tan importantes. Un ejemplo es la la inducción enzimática que se le atribuye al consumo frecuente de alimentos asados a la brasa, (así como a la exposición al humo producido durante el proceso).
•Alteraciones Enzimáticas:
–La inhibición es el proceso por el cual una droga disminuye el nivel normal de actividad de una enzima, por un proceso que puede ser competitivo o no competitivo, usualmente se manifiesta de inmediato (también suele terminar de inmediato al depurarse el inhibidor).
–La inducción, es el proceso por el cual una droga aumenta la producción de enzimas, involucra nueva síntesis de proteínas y suele durar varias semanas; la producción de enzimas tiende a disminuir una vez que el inductor se depura, pero los niveles enzimáticos pueden tardar semanas en volver a la normalidad.
–Un sustrato es una droga o compuesto capaz de ser blanco metabólico de una enzima.
•Con estas posibles interacciones, pueden presentarse seis distintas situaciones clínicas:
–Inhibidor Añadido a un Sustrato: Usualmente aumenta el nivel sérico y la posible toxicidad del sustrato o droga original
– Sustrato añadido a un Inhibidor: Reverso del primero, implicando que el sustrato alcanzará mayor nivel sérico que el esperado, con posible toxicidad .
–Inductor Añadido a un Sustrato: Disminución del nivel sérico y menor eficacia del sustrato.
–Sustrato Añadido a un Inductor: Disminución de la eficacia esperada por menor nivel sérico del sustrato.
–Remoción de un Inductor (Reversión de Inducción Enzimática): El equilibrio obtenido por la co-administración crónica de un sustrato y un inductor se rompe al descontinuar este último, por lo que los niveles séricos y la toxicidad del sustrato tienden a aumentar.
–El efecto clínico obtenido en cada uno de los seis patrones es el opuesto si el sustrato involucrado es una pro - droga.
–Remoción de un Inhibidor (Reversión de Inhibición Enzimática): La co - administración crónica de un sustrato y un inhibidor permite lograr un equilibrio, que al romperse por descontinuación del inhibidor disminuye los niveles séricos del sustrato y, por ende, su eficacia clínica.
•Lo siguientes son ejemplos de medicamentos y/u otros factores que alteran la actividad enzimática
•Inducción
•Tabaquismo
•Alcoholismo crónico
•DDT
•Fenobarbital
•Carbamacepina
•Fenitoína
•Primidona
•Rifampicina
•Inhibición
•Intoxicación aguda por alcohol
•Cloranfenicol
•Metronidazol
•Alopurinol
•Valproato
•Macrólidos
•El “Grapefruit” (jugo o fruta entera) disminuye la expresión de la isoforma CYP3A4 del citocromo P450
EXCRECIÓN
•Proceso de remoción del fármaco y/o de sus metabolitos desde el organismo hacia el exterior, sin embargo, en el contexto de la eliminación de fármacos, la excreción de fármacos se definiría solo como el proceso de remoción del fármaco inalterado, toda vez que una droga cualquiera también puede considerarse como eliminada si se ha convertido en una molécula diferente por medio de la biotransformación.
•La excreción puede darse por diversas vías, incluyendo la renal, la hepática, la pulmonar, etc., de las cuales es la primera, con mucho, la más importante.
•Independientemente de la vía, la excreción se produce con mayor facilidad cuando se trata de sustancias polares, por lo que, en la mayoría de los casos de eliminación de fármacos liposolubles, lo común es excretar los metabolitos, antes que las sustancias originales.
EXCRECIÓN RENAL
Es la vía de eliminación más importante después de la vía hepática (metabolismo). Incluye procesos positivos y negativos propios de la fisiología normal del riñón, cuya suma algebraica genera la eliminación renal neta.
•1) Filtración:
•Los capilares renales están diseñados especialmente para este proceso, por presentar múltiples poros que permiten el paso libre y rápido de toda sustancia cuyo peso molecular no exceda 69.000 Dalton; esto implica que, en condiciones normales, las sustancias que estén unidas a proteínas plasmáticas no pasarán al filtrado glomerular. Es un proceso pasivo, dirigido por el gradiente de concentración y por la diferencia de presión hidrostática entre la circulación y el contenido glomerular. En adultos normales, se filtran alrededor de 130 ml de plasma por minuto por lo que se tendrá la posibilidad de eliminar la droga presente en ese volumen de líquido.
2. Secreción Tubular:
Aunque el proceso de filtración es altamente eficaz, pueden quedar remanentes importantes de muchas sustancias que no pasen al contenido luminal de la vía urinaria. En este caso, hay la posibilidad de que se de un proceso de difusión pasiva de sustancias desde la arteriola eferente hacia el túbulo renal, proceso que, sin embargo, resulta de poca eficiencia. No obstante, existe otro proceso, en este caso activo, que permite la eliminación de sustancias, gracias a la intervención de transportadores más o menos específicos, que pueden ocuparse por sustancias diferentes. Existen dos tipos generales de transportadores, para aniones o para cationes orgánicos. Estos transportadores son sensibles a saturación y competición.
3. Reabsorción:
Independientemente del proceso que lleve una sustancia a la luz tubular, la misma puede pasar nuevamente a la circulación, mediante un proceso pasivo de difusión que sigue los mismos principios que se han desarrollado en otros apartados. Entre otros factores, son importantes de destacar la liposolubilidad y el estado de ionización de las sustancias. El estado de ionización puede depender primordialmente de la diferencia de pH entre la orina y el plasma.
•Cuando el pH de la orina es relativamente bajo, los ácidos orgánicos predominarán en su forma protonada, menos cargada y por tanto más liposoluble, por lo que tenderán a ser reabsorbidos, pasando al plasma, en el cual el pH relativamente alcalino, permitirá su ionización y “secuestro”; por otra parte, si el pH de la orina es relativamente alcalino, los ácidos orgánicos tenderán a ceder su(s) protón(es) al medio, por lo que adquirirán una carga eléctrica que dificultará su difusión, siendo entonces difícilmente reabsorbidos. Las bases débiles sufren el reverso del proceso descrito. Esta dependencia de la reabsorción respecto al pH es usada en el tratamiento de intoxicaciones por sustancias ionizables, ya que al manipular el pH urinario puede lograrse una mayor o menor excreción de esos químicos.
• Cuando la función de filtración renal está comprometida, se puede recurrir al uso de medios artificiales de eliminación de fármacos (y/o sustancias de desecho del organismo), incluyendo los procesos de hemodiálisis y diálisis peritoneal.
EXCRECIÓN HEPÁTICA O BILIAR
Sigue en importancia a la excreción renal. La excreción se produce por paso del fármaco a la bilis y, por ende, al contenido fecal definitivo, por diversos procesos de transporte. En lugar de eliminarse, las sustancias así llevadas a la luz intestinal pueden llegar a ser reabsorbidas desde la mucosa, en el proceso de circulación enterohepática. En realidad, la mayor parte de los metabolitos generados por biotransformación hepática se liberan a la sangre, desde la cual se eliminan gracias a la excreción renal.
OTRAS VÍAS DE EXCRECIÓN
•Otras vías, de menor importancia, incluyen la salival, la gastrointestinal (desde la mucosa del tracto hacia la luz), la cutánea, la lagrimal y al genital. Son de baja importancia como procesos de eliminación, aunque en algunos casos, como con la excreción salival, puede utilizarse para mediciones de niveles del fármaco que pueden tener buena correlación con los niveles plasmáticos.
•En el caso de la eliminación cutánea se incluye no solo la piel sino también las uñas y el pelo, lo que tiene valor toxicológico (acumulación tiempo - dependiente de tóxicos) y valor terapéutico (acumulación de ciertos fármacos, como los antimicóticos).
•Especial mención merece la eliminación láctea pues la cantidad de droga excretada por esa vía, puede ser suficiente para generar un efecto farmacológico en el lactante, aunque la cantidad de droga es usualmente bastante pequeña.
•La vía respiratoria de excreción es importante solamente en el caso de la anestesia inhalatoria, puesto que los fármacos terminan siendo eliminados por la misma vía de administración; en este caso, la cinética de eliminación dependerá básicamente de las diferencias de presión parcial del fármaco entre la circulación y el ambiente.